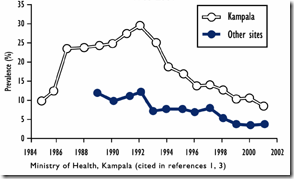
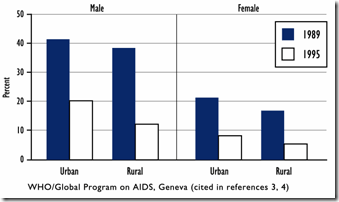
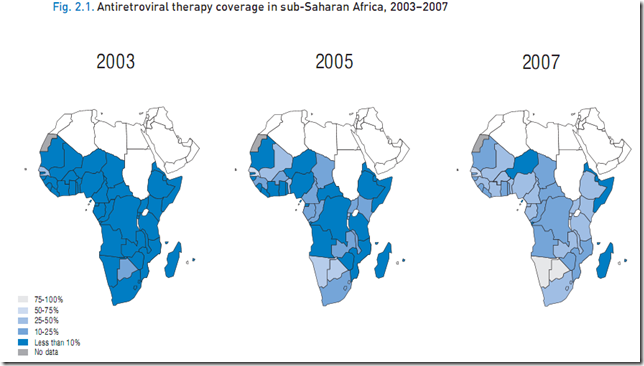
從2009年5月開始,全球就為了新型流感的防治傷透了腦筋,各國為了這個Pandemic 新病毒的的效應緊張不已,各國也展現出各自的能力去做疫情的防範,簡單說來不外乎是幾個原則: 加強監測(包括人類及動物流行病學和跨國合作)、資訊共享(透過NCBI平台公佈全部基因序列、各大醫學期刊成立2009H1N1 Novel virus特區、疫情公佈)、疫苗開發和抗流感藥物開發等等方式,希望可以利用這次新流感疫情,好好打一場新世紀的全球防疫大作戰。
這場戰爭的起源地---美洲和灘頭堡---南半球,在這場戰役中,提供了許多流行病學相關的資訊,讓比較晚進入白熱化戰區的北半球,在今年進入秋冬後可以提供有用的戰情資料和準備計畫。這場新世紀保衛戰疫中,被認為最重要的防守戰略之一,就是疫苗的製備。為了民眾的健康,各國無不使出渾身解數,希望可以在最短的時間內,完成疫苗的研發和量產,讓大家可以即時施打減輕疫情降低對人類健康的衝擊。
一般季節流感疫苗的研發,一項都有標準的機制,就是每年大概在二月的時候,由負責例行監測的世界衛生組織(WHO)進行全球流感會議,根據前一年南半球七八月冬季所流行的病毒株,經過專家會議後推測當年冬季北半球可能的流行株,選出其中兩個A型流感和一個B型流感的病毒株製造疫苗,之後透過各大藥廠的大量量產製造,在每年季節流感疫苗要上市之前,透過標準的試驗過程後,完成臨床試驗和各種標準化的試驗後,一般大概花半年的時間,在秋冬季節上市。雖然這是標準化的過程,但是有關季節流感疫苗注射後引起的併發症(如Guillain–Barré syndrome )和自閉症的爭議都始有所聞,也一直在醫界和學術界中討論,在美歐日等國是透過完整的藥物救濟法案和學術界不斷討論和研究的方式,希望透過社會公義的方式,來減輕疫苗副作用的傷害,讓民眾得到最大利益。
在WHO的新型疫苗安全建議聲明中,明白指出有鑑於1957和1968年兩次流感大流行時疫苗製備太晚,造成重大疫情的狀況,這次新流感疫苗的製備,必須能夠迅速完成,但是為了急速加溫的新流感疫情和即將進入的流感流行季節,各國為了新流感疫苗的研發,學術界和藥廠無不卯足全力衝刺,希望可以達到最好的成績,這次試煉不只是商業上的巨大利益,也是對舊有醫療倫理在臨床試驗和藥物使用規範上的巨大挑戰,因為時間緊迫、需求量大,因此如何能夠維持品質和民眾利益,就成為各國衛生部門的重大挑戰。在這種緊急狀況下,快速、安全、有效率仍然是必須追求和遵守的原則,在這種緊急狀況之下,世界衛生組織仍然希望能夠維持疫苗的安全有效率有品質的原則,然而這些原則在這次疫情緊急的狀況做了一些改變,這些改變包括透過WHO的平台即時公開資料給全球當參考,疫苗使用後的追蹤等等。許多國家為了新型流感疫苗的製備,在一些藥物上市的標準上也做了一些調整,這些調整包括:
- 過去已經擁有季節性流感疫苗藥品製造執照的藥廠在這次新流感疫苗必須送到美國藥物食品管制局(FDA)送審的資料可以簡化,不必像過去那樣嚴格。
- 歐盟的歐洲藥物署(European Medicines Agency )可以先將已經完成的資料送審,不必等到全部的資料到其之後才送審,另外歐洲也容許有Mock-up Vaccine的製備,Mock-up Vaccine指的是以過去已經研發的全球流感大流行疫苗(如H5N1)中的資料送審,因為H1N1新型流感同樣使用類似的方式製備,可以用快速審查的方式,不必準備完整的臨床試驗資料去做審查,但是歐盟藥物署要求必須附上完整的監測計畫和風險處理方案,包括必須在初期特定族群9000人的注射報告(需要包括各個年齡層)、每個月必須向歐盟藥物署提出副作用報告、特殊族群如孕婦則必須提出另外的特殊報告,歐盟藥物署會定時審議。
簡單來說就是各國為了因應疫情的需要,在原本需要嚴格審查的疫苗方面,都做了一些調整,甚至容許疫苗可以先上市,但是必須要嚴格監測上市後的副作用追蹤和採取相關的藥害救濟,因為這些疫苗其實並沒有跟過去的疫苗一樣通過事先嚴格的審查和追蹤之後才上市,因此事後的控管就顯得非常重要。在這些國家的2009H1N1新流感疫苗相關網頁中,其實都可以找到他們疫苗上市後所遇到的副作用和告知人民如何通報疫苗副作用、公部門如何給予藥害救濟給付和審查的資訊,而目前已知的這些副作用的資料和一些相關會議審查的資料,也可以在這些網頁上找到,最主要的目地就是減少因為倉促上市的傷害。在為了緊急應變的所採取的公共政策中,多數的大眾可以接受為了緊急避難所採取的緊急手段和政策,但由於這些政策並不是最理想的解決方案,因此更需要有輔助的事後審查、監督和救濟制度。相對而言,臺灣在這部分的應變措施,並沒有像這些國家這樣完善,在公部門的網頁和一些政策說明中,不能清楚的看到這些相關政策和事後審查、監督和救濟制度的資訊,這或許是公部門需要再努力跟人民說明的。
以下就目前已知已上市的新型流感疫苗中,簡單的做一些介紹 (資料來源 美國FDA網站、CDC網站、歐盟藥物署、日本厚生勞働省、國光疫苗廠網站)
疫苗名稱 | 注射方式 | 生產藥廠 | 通過執照 | 病毒成分 | 含汞成分thimerosal | 施打劑量 (六個月以下不打) | 仿單連結 | 備註 | |
不活化型 | 肌肉注射 | CSL | FDA | A 0.5-mL dose contains 15 μg hemagglutinin of A/California/7/2009 (H1N1)pdm.
| 單一劑量: 0 | 六個月至九歲者間隔四周(大於三周即可)打兩次,其他年齡層一劑 6–35 個月間隔四周(大於三周即可)打兩次一次半劑 | 由雞胚細胞培養而成 | ||
多劑量型 24.5μg | |||||||||
不活化型 ID Biomedical Corporation of Quebec Influenza A (H1N1) 2009 Monovalent Vaccine | 肌肉注射 | 在美國由GSK負責 | FDA | A 0.5-mL dose contains 15 μg hemagglutinin of A/California/7/2009 (H1N1)pdm | 25 μg | >18歲 打一劑 | ID Biomedical Corporation of Quebec Influenza A (H1N1) 2009 Monovalent Vaccine | 由雞胚細胞培養而成 | |
不活化型Sanofi Pasteur, Inc Influenza A (H1N1) 2009 Monovalent Vaccine | 肌肉注射 | Sanofi Pasteur | FDA | A 0.5-mL dose contains 15 μg hemagglutinin of A/California/7/2009 (H1N1)pdm | 0.25 mL prefilled syringe- -0 μg | 6–35 個月間隔四周(大於三周即可)打兩次一次半劑 | Sanofi Pasteur, Inc Influenza A (H1N1) 2009 Monovalent Vaccine | 由雞胚細胞培養而成 | |
0.5 mL prefilled syringe---0 μg | ≥36個月 六個月至九歲者間隔四周(大於三周即可)打兩次,其他年齡層一劑 6–35 個月間隔四周(大於三周即可)打兩次一次半劑 | ||||||||
5.0 mL multidose vial---25ug | 大於六個月六個月至九歲者間隔四周(大於三周即可)打兩次,其他年齡層一劑 6–35 個月間隔四周(大於三周即可)打兩次一次半劑 | ||||||||
不活化型 Novartis Vaccines and Diagnostics Limited Influenza A (H1N1) 2009 Monovalent Vaccine | 肌肉注射 | Novartis Vaccines and Diagnostics Limited | FDA | A 0.5-mL dose contains 15 μg hemagglutinin of A/California/7/2009 (H1N1)pdm | 5.0 mL multidose vial—25 μg | 大於四歲 六個月至九歲者間隔四周(大於三周即可)打兩次,其他年齡層一劑 | Novartis Vaccines and Diagnostics Limited Influenza A (H1N1) 2009 Monovalent Vaccine | 由雞胚細胞培養而成 | |
0.5 mL prefilled syringe--0 μg | |||||||||
活病毒型 MedImmune LLC Influenza A (H1N1) 2009 Monovalent Vaccine Live, Intranasal | 鼻腔吸入 | MedImmune LLC | FDA | Live attenuated influenza vaccine. A 0.2-mL dose contains 106.5—7.5 fluorescent focal units of live attenuated influenza virus reassortants of A/California/7/2009 (H1N1)pdm. | 0.2 mL sprayer--0 μg | 2–49 yrs 六個月至九歲者間隔四周(大於三周即可)兩次,其他年齡層一劑 | MedImmune LLC Influenza A (H1N1) 2009 Monovalent Vaccine Live, Intranasal | 氣喘患者不可使用 | |
不活化型 日本H1N1 Influenza A | 皮下注射 | 北里 | 日本厚生勞働省 | A 0.5-mL dose contains 15 μg hemagglutinin of A/California/7/2009 (H1N1)pdm | 一歲以下打0.1ml 間隔四周分兩次打 | 由雞胚細胞培養而成 | |||
不活化型 臺灣國光H1N1疫苗 | 皮下注射 | 國光藥廠 | 臺灣衛生署 | A 0.5-mL dose contains 15 μg hemagglutinin of A/California/7/2009 (H1N1)pdm | 十歲以上一劑 三歲到十歲兩次 間隔三周施打 一歲到三歲一次半劑間隔兩周施打 | 由雞胚細胞培養而成 | |||
不活化型 Focetria
| 肌肉注射 | Novartis | 歐盟 | A 0.5 ml dose contains 7.5 ug hemagglutinin of A/California/7/2009 (H1N1)pdm | 0 但有佐劑 MF59C | 2–49 yrs 六個月至九歲者間隔四周(大於三周即可)兩劑,其他年齡層一劑 | 由雞胚細胞培養而成 | ||
肌肉注射 | Baxter | 歐盟 | A 0.5 ml dose contains 7.5 ug hemagglutinin of A/California/7/2009 (H1N1)pdm | 0 | >18歲 可能需打兩劑 十八歲以下資料不足 | 由哺乳類動物的Vero Cell培養而成非由雞胚細胞培養而成 | |||
不活化型 | 肌肉注射 | GSK | 歐盟 | A 0.5 ml dose contains 3.75 ug hemagglutinin of A/California/7/2009 (H1N1)pdm | 0 但有佐劑 AS03 | >18歲兩劑 9-17歲可能同成年人 六個月到九歲者一次半劑間隔三周打兩劑 | 由雞胚細胞培養而成 | ||
美國標準劑量為0.5 ml | |||||||||
參考資料
- Regulatory preparedness for human pandemic influenza vaccines. Report of a WHO Expert Committee on Biological Standardization. Geneva: World Health Organization, 2007 [pdf 625kb]
- CHMP explanatory note on scientific considerations regarding the licensing of pandemic A(H1N1)v vaccines
- FDA流感疫苗網站
- CDC流感疫苗網站
- 歐盟藥物署流感疫苗網頁
- 日本厚生勞働省流感疫苗網頁
- 國光疫苗廠網站